O výskume
Myšlienka realizácie vybudovania pivných kúpeľov je založená na využití prírodných surovín obsahujúcich látky, ktoré pri správnom použití budú priaznivo pôsobiť na zdravotný stav jednotlivca. Hlavnými prvkami sú kvasinky Saccharomyces cerevisiae, extrakt z obilnín a chemeľové hlávky rastliny Humulus lupulus.
Ľudstvo sa z historického hľadiska od momentu objavu existencie mikroorganizmov zameriava na ich využitie v rôznych odvetviach. Benefity mikroorganizmov sú aplikovateľné v procese prípravy liečiv, potravín a nápojov. Uplatnenie kvasiniek ako jednobunkových mikroorganizmov sa objavuje čoraz intenzívnejšie aj v regeneračných a relaxačných procedúrach. V dobe, v ktorej na človeka pôsobí veľká škála stresových faktorov fyzického alebo psychologického charakteru je výskum zameraný najmä na pozitívne pôsobenie mikrobiálnych metabolitov na ľudské zdravie. Práve spojenie relaxačného vplyvu kúpeľov a pozitívneho vplyvu mikrobiálnych metabolitov na ľudské zdravie viedlo k vytvoreniu myšlienky kúpeľov s obsahom rastlinných a mikrobiálnych komponentov obsiahnutých v pive.
Kvasinky patria medzi jednobunkové organizmy, ktorých metabolizmus je možné ovplyvňovať vonkajšími podmienkami. Regulácia ich metabolizmu môže byť uskutočňovaná zmenou fyzikálnych ( teplota, tlak, aerácia, žiarenie) a chemických ( pH, zastúpenia iónov, druh uhlíkatého substrátu, zdroj uhlíka atď. ) podmienok. Vhodné nastavenie týchto podmienok môže viesť k nadprodukcií vybraných metabolitov. V prípade kvasinkovej biomasy a vplyvu na človeka sú zaujímavé metabolity ako koenzým Q, kardiolipín, beta-glukány a mikrobiálne oleje a pigmenty. Spoločnosť JFcon sa v spolupráci s výskumnými pracovníkmi zameriava práve na využitie kvasinkovej biomasy v z procesu výroby fermentovaných nápojov. Táto biomasa následne predstavuje vhodný zdroj pre extrakciu koenzýmu Q, karotenoidných pigmentov a beta-glukánov. V prípade použitia kvasničnej biomasy bez extrakcie sme sa zamerali na usmrtenie buniek metódami, ktoré nespôsobujú intenzívnu degradáciu týchto metabolitov. V prípade bežného sušenia kvasníc dochádza spolu s prístupom kyslíku k oxidácií uvoľnených intracelulárnych metabolitov, čím sa následne znižuje aj ich účinok. Preto ako najvhodnejší postup sme stanovili tlakovú homogenizáciu s následným rýchlym zmrazením a lyofilizáciou. Inovatívnym prínosom pre relaxačno-kúpeľné odvetvie predstavuje použitie kvasiniek, ktoré produkujú vysoké množstvo intracelulárnych lipidov a pigmentov. V prípade pigmentov ide o využitie kvasinky Rhodotorula glutinis. Prvé realizované výskumy sú zamerané na možné využitie zostatkových cukrov po procese prípravy sladiny v pivovaroch. Po procese výroby sladiny je zvyšná rastlinná biomasa (mláto) podrobená procesu hydrolýzy v kyslom prostredí, pri ktorom dochádza k rozkladu dlhoreťazcových cukrov na menšie jednotky, ktoré sú následne utilizované kvasinkovým kmeňom. Táto inovácia prispieva k takzvanému „zero-waste“ priemyslu, ktorá v spojení s biotechnologickými poznatkami umožní premeniť vedľajšie produkty na východiskové suroviny ďalších procesov.
Pre následné biotechnologické využitie získaného hydrolyzátu obsahujúceho zmes monosacharidov a polysacharidov je potrebné zvoliť vhodné podmienky kultivácie. Biochemická činnosť̌ mikroorganizmov je ovplyvnená viacerými fyzikálno-chemickými parametrami. Medzi základné faktory radíme zdroj, množstvo a vzájomný pomer uhlíka a dusíka, pH, teplotu, vodnú aktivitu prostredia a prítomnosť žiarenia. Pre dosahovanie maximálnych výťažkov biotechnologických produkcií je nevyhnutá a kľúčová optimalizácia kultivačných parametrov. V prípade kultivácie kvasinky R.glutinis výťažky jednotlivých pigmentov výrazne závisia od zdroja uhlíka. Podľa práce El-Banna a kol. (2011) sa po 72 h kultivácie dosahujú podobné výťažky celkových pigmentov pri použití glukózy (výťažok 1,76 mg/L) a sacharózy (výťažok 1,81 mg/L).
Práve preto boli vykonané prvotné kroky k zisteniu schopnosti kvasinky R.glutinis utilizovať rôzne druhy uhlíkatého substrátu s dôrazom na množstvo získanej biomasy a celkových karotenoidných pigmentov. Podmienky kultivácie sú zobrazené v tab.č.1. a zloženie médií je zobrazené v tab.č.2..
Tab.č.1.: podmienky kultivácie kvasinky R.glutinis
| Petriho misky- sladinový agar | ||
| teplota | 25°C | |
| ot. /min | staticky – stále osvetlenie | |
| čas | 96 hodín | |
| Inokulačné médium | ||
| teplota | 28°C | |
| ot. /min | 180 rpm – stále osvetlenie | |
| objem média | 30 mL v 100 mL Erlenmayerovej banke | |
| čas | 72 hodín | |
| Produkčné médium | ||
| teplota | 28°C | |
| ot. /min | 180 rpm – stále osvetlenie | |
| objem média | 20 mL v 100 mL Erlenmayerovej banke | |
| dĺžka kultivácie | 168 hodín | |
Tab.č.2.: zloženie kultivačných médií
| zdroj uhlíka | počiatočná koncentrácia substrátu | koncentrácia kvasničného autolyzátu, g/l |
| glukóza | 50 g/l | 5 |
| arabinóza | 50 g/l | 5 |
| sacharóza | 50 g/l |
5 |
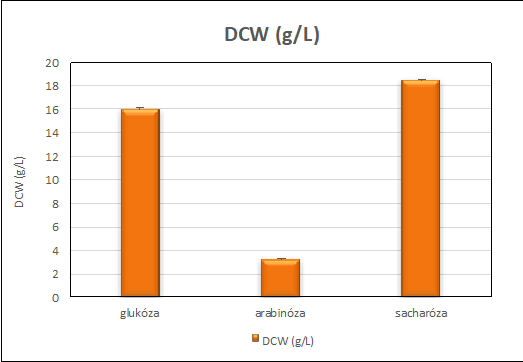 Obr. č.1.: dosiahnuté množstvo suchej biomasy v procese kultivácie v závislosti od použitého zdroja uhlíka
Obr. č.1.: dosiahnuté množstvo suchej biomasy v procese kultivácie v závislosti od použitého zdroja uhlíka
Glukóza ako aj sacharóza je pre kvasinku ľahko utilizovateľný zdroj uhlíka a energie, čo umožňuje rýchly nárast mikroorganizmu. Preto sme získali najväčšie hodnoty nárastu biomasy 18,5 g/L DCW použitím sacharózy a pre glukózu 16,0 g/L DCW. Dosiahli sme takmer 95% utilizáciu týchto C-zdrojov, pričom zostatok substrátu v médiu nepresiahol 5 g/L. Naopak najnižší nárast pozorujeme pri kultivácií na arabinóze (3,1 g/L). Podobný nárast biomasy na arabinóze zaznamenal aj Latha a kol. (2004) a to 4,1 g/L po 12 dňoch kultivácie. O tom svedčí aj fakt, že spotreba arabinózy bola veľmi nízka (8%), obsah arabinózy v produkčnom médiu po kultivácii bol až 46 g/L. Tento substrát teda nie je vhodný pre kultiváciu R. glutinis CCY 20-2-26. Z hľadiska produkcie pigmentov na obr. č. 2 je znázornená celková produkcia karotenoidov kvasinkou Rhodotorula glutinis. Tak ako aj pri náraste biomasy, tak aj pri produkcií pigmentov zaznamenávame najmenšie hodnoty akumulácie a výťažky pri arabinóze. Podobné výsledky v produkcií pigmentov pozorujeme pri glukóze a sacharóze s akumuláciou 330- 352 μg/g a výťažkom 6,0 g/L.
Pre meranie obsahu a zloženia karotenoidných pigmentov bolo zo vzorky lipidického extraktu odobratých 200 μL. Pigmenty sme analyzovali pomocou vysokoúčinnej kvapalinovej chromatografie (HPLC) prístrojom HP 1100 (Agilent) vybaveným DAD detektorom. Do kolóny LiChrospher® 100 RP-18 (5 μm) (Mercx) sa nastrekovalo 10 μL vzorky extraktov pigmentov. Analýza prebiehala pri nasledovných podmienkach: prietok rozpúšťadiel (rozpúšťadlo A: zmes acetonitrile/voda/kys. mavčia v pomere 86:10:4 obj.; rozpúšťadlo B: zmes etylacetát/kyselina mravčia v pomere 96:4 obj.) bol 1mL/min s gradientom 100% A v čase 0 min, 100% B v čase 20 min a 100% A v čase 30 min. Karotenoidné pigmenty sme identifikovali pomocou známych štandardov (Sigma, Germany) a záznamy sme vyhodnotili pomocou ChemStation B 01 03 (Agilent technologies). Záznamy sme kvantifikovali na základe retenčných časov známych karotenoidných štandardov (Sigma, Germany), ktoré boli merané pri rovnakých podmienkach ako naše vzorky.

Obr.č. 2: Prístroje (HPLC) na kvantitatívne aj kvalitatívne stanovenie karotenoidných pigmentov.
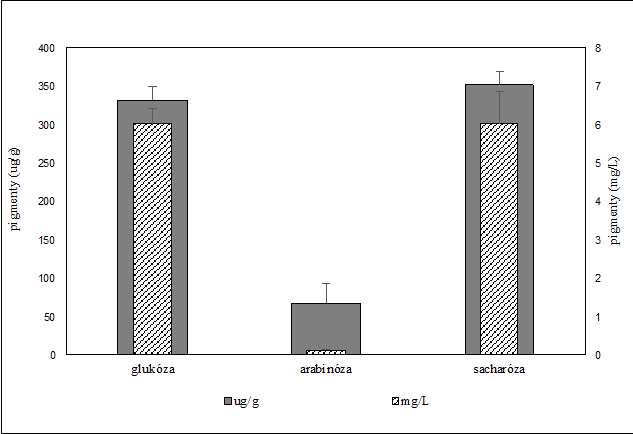
Obr. č.3.: graf výťažku a akumulácie celkových pigmentov v závislosti od druhu použitého zdroju uhlíka
Izolácia lipidov a karotenoidných pigmentov prebiehala pomocou modifikovaného postupu podľa Folcha a kol. (1957):
- suchá lyofilizovaná biomasa sa zhomogenizovala s morským pieskom v trecej miske s roztieradlom
- k takto pripravenému homogenizátu bolo pridaných 40 ml extrakčnej zmesi (Folchovo činidlo – chloroform: metanol = 2:1) a zmes sa nechala za občasného premiešania extrahovať 1 hod
- po hodine sa kvapalný podiel odfiltroval a k tuhému podielu sa znova pridalo 25 mL extrakčnej zmesi a zmes sa nechala za občasného premiešavať 30 min
- kvapalný podiel sa znova prefiltroval a spojil sa s prvým filtračným podielom
- k tomuto podielu sa pridal 1,2 násobok (72 ml) destilovanej vody na purifikáciu
- po centrifugácii (3500 ot/min, 5 min) sa vodno-metanolický podiel odsaje pomocou vodnou vývevy
- chloroformový podiel sa prefiltruje cez bezvodný síran sodný do vopred zváženej banky slzy
- chloroform sa odparí na rotačnej vákuovej odparke a množstvo lipidu sa určí gravimetricky
- lipid sa pomocou 1 ml zmesi hexán:chloroform = 9:1 prenesie do mikrocentrifugačnej skúmavky pre ďalšie analýzy.

Obr.č.4: Izolačný systém pri oddelovaní vodnej a organickej fázy, v ktorej sú rozpustené lipidy spolu s karotenoidnými pigmentami.
Na základe zloženia sladiny, ktorá obsahuje najmä maltózu a maltotriózu bola analyzovaná schopnosť R glutinis utilizovať dané oligosacharidy. T. Schneider a kol (2013). zistili, že intenzita utilizácie maltózy súvisí najmä s obsahom iných zdrojov uhlíka v médiu pričom po 264 h dosiahli utilizáciu mlatózy 2,62 g/l. Následne boli preto uskutočnené experimenty sledujúce zastúpenie a množstvo zvyškových cukrov získaných po procese výroby sladiny. Mláto po výrobe sladiny bolo sušené pri teplote 80 °C čím sa predišlo kontaminácií najmä vláknitými hubami. Takto získaný suchý substrát následne slúžil ako zdroj uhlíka pre následnú mikrobiálnu kultiváciu. Boli uskutočnené dva postupy:
- macerácia vo vodnom roztoku
- macerácia spojená s hydrolýzou v kyslom prostredí
Príprava vzorky v prípade výluhu (bez pridania kyseliny sírovej) bola uskutočnená zmiešaním 15 mg mláta so 150 ml vriacej vody. Po následnom krátkom miešaní bola vzniknutá zmes umiestnená do autoklávu (121 °C, 20 min), čím došlo jednak ku sterilizácií média a zefektívneniu macerácie vplyvom vysokej teploty pri zvýšenom tlaku. Následne bola zmes umiestnená na magnetické miešadlo a lúhovanie ďalej pokračovalo pri teplote 50 °C 16h. V prípade prípravy hydrolyzátu bolo 30 mg mláta zmiešaných s 1% kyselinou sírovou na 2 h. Pre dodržianie podobnosti s prvým postupom bola vzorka taktiež umiestnená do autoklávu pričom čas v autokláve bol predĺžený na 1 h. Následne sa vzorka prefiltrovala cez Buchnerov lievik pre oddelenie pevnej a kvapalnej fázy a pH roztoku sa upravila na hodnotu 7 pridaním potrebného množstva uhličitanu vápenatého.Následne získané extrakty boli využité ako zdroj živín pre rast kvasinky R. glutinis. Podmienky kultivácie sú zobrazené v tabuľke č.1.
|
Podmienky kultivácie, zloženie médií |
|
| P. miska | 7%SA |
| 4 dni | |
| 25°C | |
| žlté svetlo | |
| Inokulum 20 ml | 2% glukóza |
| 1% peptón | |
| 1% kvasničák | |
| 28°C, 180 rpm | |
| žlté svetlo | |
| Produkčné 20 ml | Výluh/Hydrolyzát |
| 3 g/L kvasničák | |
| 28°C, 180 rpm | |
|
žlté svetlo |
|
V prvom kroku výskumu bola vykonaná analýza získaných výluhov. Metóda kvalitatívneho a kvantitatívneh stanovenia bola vykonaná HPLC metódou. V prípade vykonania hydrolýzy bolo dosiahnuté vyextrahovania takmer 4,5 násobného množstva uhlíkatých látok. Zmenil sa aj profil a zastúpenie jednotlivých zdrojov uhlíku. Došlo takmer k 30 násobnému zvýšeniu koncentrácie glukózy. V prípade hydrolýzy došlo aj k navýšeniu koncentrácie arabinózy avšak tá je pre R.glutinis neutilizovateľný zdroj uhlíka.
Kvalitatívny profil pre VM (výluh z média) a HM (hydrolyzát z média) je zobrazený na obr.č.3. a obrázku č.4.
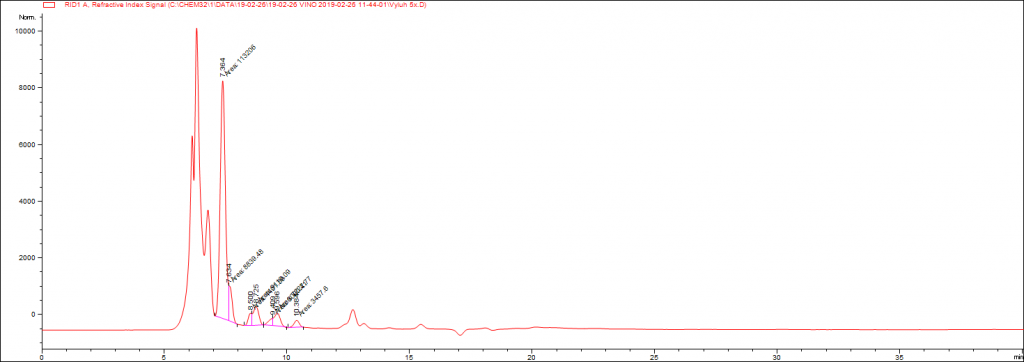 Obr.č.5. : Výsledné zastúpenie jednotlivých uhlíkatých molekúl v prípade VM
Obr.č.5. : Výsledné zastúpenie jednotlivých uhlíkatých molekúl v prípade VM
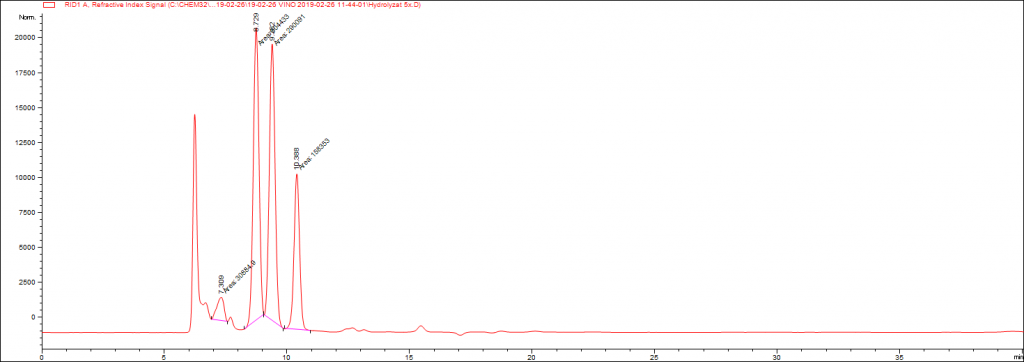
Obr.č.6. : Výsledné zastúpenie jednotlivých uhlíkatých molekúl v prípade HM
V prípade uskutočnenia kyslej hydrolýzy došlo aj k uvoľneniu xylitolu, ktorý sa zaraďuje medzi polyoly. Tento polyol predstavuje vhodnú náhradu sladidla pre ľudí trpiacimi diabetes melitus. Následne bol do získaných extraktov pridaný kmeň kvasinky R.glutinis. V prípade kultivácie na HM došlo k dvojnásobnému navýšeniu suchej biomasy (DCW – z angl. dry cell weight ). V prípade HM nedošlo k 100% utilizácií C-zdroja. Týmto uhlíkatým zdrojom bola arabinóza, ktorá nie je kvasinkou R.glutinis utilizovateľná. V prípade HM sme dosiahli DCW 9 g/l. V ďalších krokoch bude vykonaná extracia koenzýmu Q, lipidov a karotenoidných pigmentov z biomasy tejto kvasinky. Tento výskum ukazuje veľký potenciál odpadného produktu pivnej výroby na biotechnologickú produkciu zdraviu prospešných látok. V ďalších krokoch budú uskutočnené podobné kultivácie s využitím enzýmových preparátov na uskotočnenie hydrolýzy s cieľom zamedzenia potencionálneho nebezpečia v prípade použitia kyseliny sírovej pri následnom použití produktov pre človeka.

Obr.č.7 : kultivácia kvasinky R.glutinis v Erlenmayerových bankách
Z hľadiska využitia kvasinkových a rastlinných beta-glukánov budú uskutočnené experimenty zamerané na ich kvantitatívne stanovenie pri aplikácií obilnej a kvasinkovej biomasy do vodného roztoku, čo bude dôležité pre stanovenie dostatočnej hmotnosti biomasy, ktorá bude aplikovaná do kúpeľa.
Použitie chmeľu do vodného kúpeľu súvisí s viacerými zdravotnými aspektami. Chmeľ obsahuje široké spektrum silíc, ktorých senzorické vlastnosti spôsobujú psychické uvoľnenie a predstavujú vhodnú a z nášho pohľadu lepšiu náhradu umelých esencií používaných v kúpeľnom odvetví. Za veľké pozitívum považujeme spojenie chmeľových látok s prevenciou kancerogénnych ochorení. Gerhauser a kol. (2005) opísali antioxidačné vlastnosti xantohumolu obsiahnutého v chmele. V prípade použitia xantohumulonu dosiahli 8,9 násobné antioxidačné vlastnosti voči štandardu Trolox, ktorý sa používa v metóde ORAC ( z angl. oxygen radical absorbance capacity). Práve v našom výskume sú uskutočňované prvé kroky zamerané na stanovenie antioxidačnej aktivity jednotlivých chmeľových extraktov, resp.výberu najvhodnejších odrôd chmeľu s vysokou antioxidačnou schopnosťou, ktorá je spojená s horkými chmeľovými kyselinami a polyfenolmi.
Kontaktujte nás
Sídlo spoločnosti:
JFcon, s.r.o.
Družstevná 942/6
Liptovský Mikuláš 031 01
IČO: 46 347 909
IČ DPH: SK2023351429
Zapísaný v OR SR OS ZA
Odd.Sro. Vl.č:557307/L
research@jfcon.sk
+421 948 165 102
